Nemetāli ir ķīmiskie elementi, kuriem vienkāršas vielas veidā nepiemīt metālu īpašības, vai arī piemīt tikai dažas no tām. Nemetāliem parasti ir vāja siltumvadītspēja un vāja elektrovadītspēja.
No pazīstamajiem ķīmiskajiem elementiem 22 ir nemetāliskie elementi:
1.periodu veido divi nemetāliskie s elementi – H un He.
Citi nemetāliskie elementi ir p elementi (IIIA – VIIIA apakšgrupu elementi). To atomiem ārējā enerģijas līmenī ir 3 – 8 elektroni.
Dažām nemetālisko elementu grupām ir nosaukumi, piemēram:
• VIIIA grupas nemetālus sauc par cēlgāzēm,
• VIIA grupas nemetālus – par halogēniem jeb sāļražiem.
Īpašības
Nemetālu ķīmiskās īpašības ir ievērojami daudzveidīgākas par metālu ķīmiskajām īpašībām. To izskaidro ar dažādu nemetālisko elementu atomu ļoti daudzveidīgo uzbūvi. Nemetālisko elementu atomi ārējā enerģētiskajā līmenī var saturēt no viena elektrona, piemēram, ūdeņradis līdz astoņiem elektroniem, piemēram, cēlgāzes:
Nemetāli dabā ir sastopami gan brīvā veidā (cēlgāzes, skābeklis, sērs, slāpeklis, ogleklis), gan savienojumu veidā, piemēram: SiO2 – kvarcs, Ca3(PO4)2 – fosforīti, apatīti, FeS2 – pirīts, NaCl – akmeņsāls (halīts)
Šo atomu uzbūves īpatnību dēļ nemetāli ķīmiskajās reakcijās var gan pievienot elektronus, iegūstot stabilu atoma elektronapvalku ar astoņiem elektronien, gan arī elektronus atdot. Līdz ar to nemetāliem ir izteiktas gan oksidētāju, gan arī reducētāju īpašības. Tiem raksturīgi ķīmiskie savienojumi gan ar negatīvām, gan pozitīvām oksidēšanās pakāpēm.
Hlors reakcijā ar metālu bromīdiem un jodīdiem darbojas kā oksidētājs.
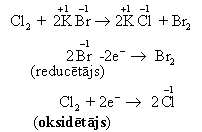
Nemetālu reaģētspēja ir ļoti atšķirīga. Lielākā daļa no tiem istabas temperatūrā ir diezgan inerti, tomēr to reaģētspēja strauji palielinās, paaugstinot temperatūru kā arī katalizatora klātienē. Piemēram, ūdeņraža un skābekļa maisījumu var uzglabāt daudzus gadus, nekāda ķīmiskā reakcija nenotiek. Taču pietiek tikai ar vienu dzirksteli vai sērkociņa liesmu un sākas strauja ķīmiskā reakcija, kas var beigties ar sprādzienu.
Vismazākā reaģētspēja ir cēlgāzē, kuru atomiem raksturīgs noslēgts elektronapvalks ar astoņiem elektroniem. Ķīmiķi ilgus gadus uzskatīja, ka cēlgāzes nepiedalās nevienā ķīmiskajā reakcijā. Tikai pagājušā gadsimta otrajā pusē ieguva pirmos cēlgāzu savienojumus:
Xe + F2 = XeF2
Xe + 2 F2 = XeF4
Xe + 3 F2 = XeF6
Savukārt visreaģētspējīgākais nemetāls ir fluors, kurš reaģē ar daudziem elementiem pat -150 0C temperatūrā un tumsā.
Ar metāliem ķīmiskās īpašības
Visi nemetāli, izņemot cēlgāzes, reaģē ar metāliem. Daudzas no šīm reakcijām izmanto tautas samniecībā svarīgu vielu un materiālu ieguvei, piemēram, vienu no baltajiem pigmentiem cinka oksīdu ZnO iegūst, sadedzinot pulverveida cinku skābeklī:
2 Zn + O2 = 2 ZnO
Skābeklis reaģē ar gandrīz visiem metāliem, veidojot oksīdus:
Cu + O2 = 2 CuO
Skābekļa reakcijās ar metāliem izdalās ievērojams siltuma daudzums.
Tomēr daži visinertākie metāli, piemēram zelts un sudrabs ar skābekli tieši nereaģē.
Arī halogēni – fluors, hlors, broms un jods – reaģē ar lielāko daļu no metāliem:
2 Na + Cl2 = 2 NaCl
Šajās reakcijās iegūst halogēnūdeņražskābju sāļus fluorīdus, hlorīdus, bromīdus un jodīdus. Gandrīz visas šīs reakcijas ir eksotermiskas.
Ievērojami inertāks ir sērs – ar metāliem tas reaģē tikai sildot:
Zn + S = ZnS
Ļoti inerts istabas temperatūrā ir slāpeklis. kurš ar metāliem reaģē ļoti augstā temperatūrā, izņemot magniju un litiju, kuru reakcijas notiek ļoti viegli:
6 Li + 3 N2 = 2 Li3N
Ar nemetāliem ķīmiskās īpašības
Nemetālu reakcijas ar citiem nemetāliem ir daudzu tautas saimniecībā ļoti svarīgu savienojumu ieguves avots.
Šodienas lauksamniecība nav iedomājama bez slāpekļa minerālmēsliem. Viena no galvenajām izejvielām to ieguvei ir amonjaks NH3, kura dabā praktiski nav. Amonjaku iegūst sintētiski slāpekļa reakcijā ar ūdeņradi:
2 N2 + 3 H2 = 2 NH3
Reakcija notiek speciālos reaktoros paaugstinātā temperatūrā un paaugstinātā spiedienā, kā arī katalizatora klātienē.
Daudzās nozarēs, tai skaitā medikamentu ražošanā, nepieciešama sālsskābe ar ļoti augstu tīrības pakāpi. Šim nolūkam ūdenī šķīdina hlorūdeņradi, kuru iegūst hlora reakcijā ar ūdeņradi:
Cl2 + H2 = 2 HCl
Izkausēta sēra reakciju ar skābekli izmanto sēra(IV) oksīda iegūšanai:
S + O2 = SO2
Sēra(IV) oksīds ir viena no izejvielām sērskābes ražošanai.
Viena no pazīstamākajām nemetālu reakcijām savā starpā ir skābekļa reakcija ar ūdeņradi, kurā vienīgais gala produkts ir ūdens:
O2 + 2 H2 = 2 H2O
Reakcijā izdalās ievērojams enerģijas daudzums. Daudzi zinātnieki visā pasaulē strādā pie tā, lai radītu ērti izmantojamus automobīļus, kuros ūdeņnradis kā enerģijas avots aizstātu tradicionālo benzīnu vai dīzeļdegvielu un neradītu praktiski nekādu piesārņojumu apkārtējai videi.
